このコーナーでは、コラム形式で「不妊・産む・産まない」にまつわる国内外のニュースやリサーチを紹介していきます。
私は、“がんと生殖医療の連携”を大きなテーマとして研究をしている大学院生です。今回は私の研究テーマでもあるがんと生殖医療の概要と、妊孕性温存治療の一つである卵巣凍結保存についてお話したいと思います。
これまでのがん治療、顕在化する課題
近年、抗がん剤治療や化学療法をはじめとするがん医療の進歩や、国や地域をあげてのがんの予防・検診・治療・緩和ケアなどの取り組みにより、がんは「治る病気」になってきています。
しかし、その一方で、がん治療によって引き起こされる、妊孕性(*注1)の消失、早発閉経(*注2)、卵巣機能不全など、若くしてがんを患った患者のがん寛解後の問題が顕在化しています。
抗がん剤は一般的に、がんのように細胞分裂が速い細胞に作用する薬です。しかし、正常細胞の中にも細胞分裂が速い細胞があります。その一つが生殖細胞である卵子や精子なのです。
抗がん剤はがん細胞だけでなく、正常細胞を含む細胞分裂の速い不特定多数の細胞を攻撃するため、抗がん剤による生殖細胞への影響は避けられません。
そして残念ながら、一度傷ついてしまった生殖細胞を治すことは、今の医学ではできません。
がんを克服したとしても、その過程で妊娠する可能性を失ったと後で知れば、若いがん患者の多くは計り知れないほど大きな打撃を受けることでしょう。
これまで、医療者は若年がん患者に対して「がんを治療する」ことを何よりも優先してきたこともあり、患者にこうした治療の影響を事前に知らせないことが多かったのです。また、治療に専念させるため、患者の家族が本人に知られないようにすることもありました。
(*注1)妊孕性(にんようせい):妊娠する力
(*注2)早発閉経(そうはつへいけい):40歳未満で月経がこなくなること
“Oncofertility”とは
しかし前述の通り、近年では「がんは治る病気」と言われるようになり、がんと診断された女性のQOL(生活の質)の向上・維持を考えるなかで、妊孕性の温存治療に目が向けられるようになりました。
2006年にノースウェスタン大学のWoodruffらが初めてOncofertility(がん・生殖医療学)という概念を提唱しました。
OncofertilityとはOncology(腫瘍学)とFertility(生殖医学)を合わせた造語です。Oncofertilityの概念のもとに、日本でもがん治療専門医と生殖医療専門医の十分な連携が重要視され、がん治療前から妊孕性温存に対する十分な理解と対策講じられるようになってきています。
『がん・生殖医療協会-若年がん患者における妊孕性への取り組み』
<The Oncofertility Consortium—addressing fertility in young people with cancer>
(出典:Nature Communications/2010年5月25日)
“Oncofertility”とは
ー以下、日本語概要
▼ “Oncofertility” という造語は2006年に作られたものだが、その歴史は1971年までさかのぼる。
▼ 1971年、当時アメリカ大統領だったRichard Nixonが「米国がん対策法」に署名し、がんの早期発見とより積極的な治療を提供する国立研究所の設立を認めた。
▼ 時を同じくして、生殖医学の研究者たちは、不妊の女性を支援する新しい技術を開発していた。1978年には、世界で初めての体外受精によってLouise Brownが誕生。
▼ 今日では、体内で成熟した卵子や凍結保存した胚を使用した体外受精は日常的に行われており、それによって誕生する子どもの数も増え続けている。
▼ しかし、卵母細胞を凍結保存する技術は未だ非効率的なもので、今も研究が進められている。
▼ 進化を続けてきたがん治療と生殖医療の技術は、若い患者の妊孕生温存のために力を合わせ、妊娠するための選択肢をもっと前から提示すべきだった。
▼ 概念上、がん治療と生殖医療の連携は論理的で避けられないことのように思えるが、実際は腫瘍学と生殖医学という異なった専門分野を掛け合わせることであるため、複雑なことでもあった。
現在の妊孕性温存治療としては、受精卵凍結(*注3)、卵子凍結(*注4)、卵巣組織凍結(*注5)が挙げられます。
がん治療の緊急性や生理周期との関係などから、受精卵凍結や卵子凍結は、必ずしも十分な数の卵子を採取できるとは限りません。そこで最近では卵巣組織凍結が注目されるようになり、2016年5月、京野アートクリニックの京野廣一理事長により卵巣バンク(*注6)が設立されました。
卵巣組織凍結ではまず、がんの治療前に患者の片側卵巣を摘出、または部分的に切除し、それらを切片にして、凍結保存します。がんの治癒後、凍結保存していた卵巣組織を本人の体に再移植することになります。そうすることで周期的な排卵が数年続くようになり、自然妊娠の可能性が生じます。
しかし、その一方で、がん治療前に採取した卵巣組織の移植にはがん細胞の再導入の危険性があります。そこで摘出した卵巣組織切片を凍結保存し、必要になったときに融解します。
そして、それらから発育途中の卵母細胞(*注7)を採取し、体外で発育、成熟、受精させることができれば、がんの再発のリスクを回避し、より安全な治療法の提供が可能になると考えられています。
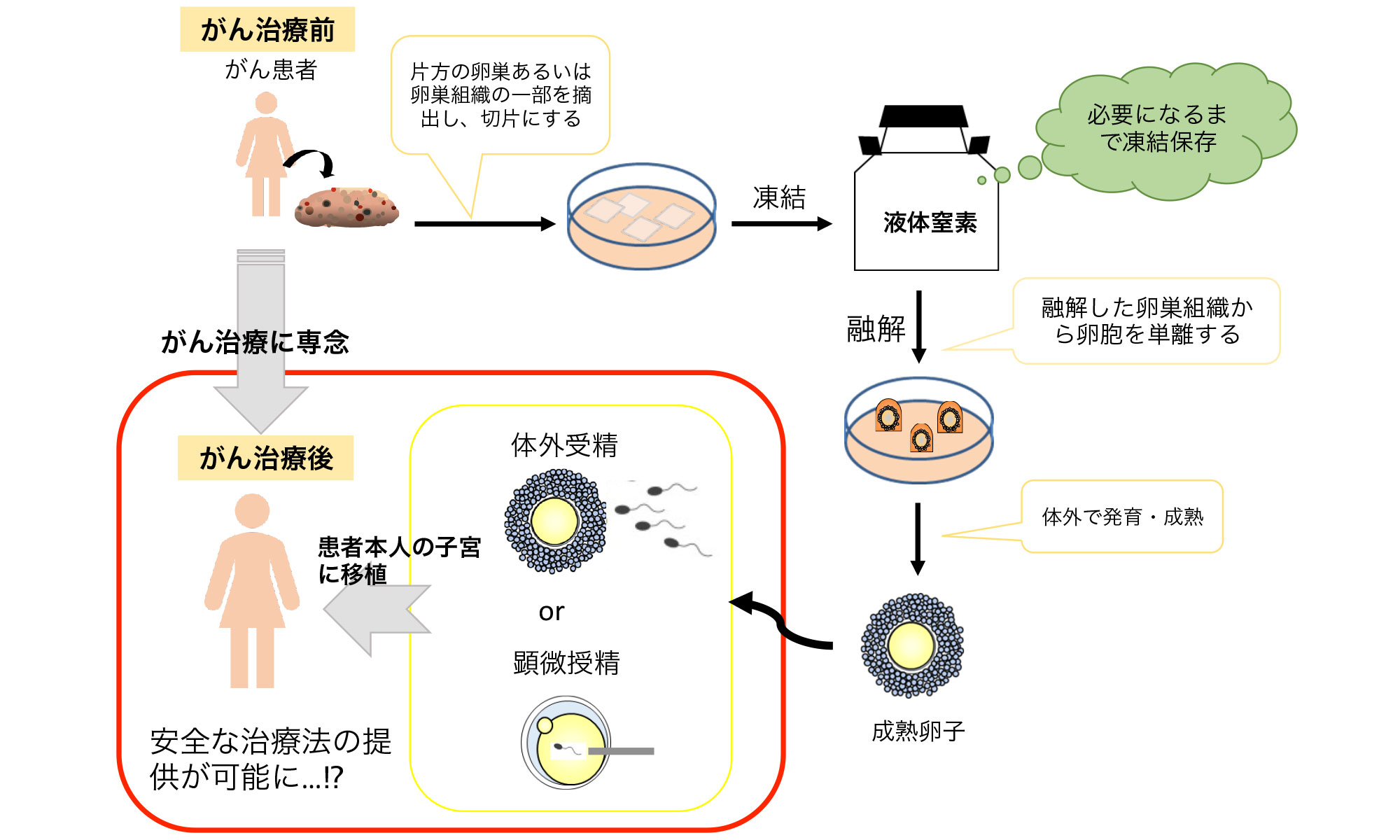
すでにマウスにおける基礎研究では、2006年10月兵庫医科大学の長谷川昭子博士らにより、凍結卵巣組織切片から卵胞(*注8)を採取し、体外で発育・成熟・受精させて正常な産仔(*注9)を得たという報告があり、今後の進展に期待できる研究の一つであると私は考えています。(*注10)
(*注3)受精卵凍結: 体外受精や顕微授精で受精させ、発育させた卵子を凍結して長期間保存しておく方法
(*注4) 卵子凍結:卵巣から採取した卵子を受精させずにそのまま凍結して長期間保存しておく方法
(*注5) 卵巣組織凍結:開腹手術や腹腔鏡下手術で片側卵巣の摘出あるいは部分切除をしたあと、それらを切片にし、凍結保存する方法
(*注6)参考リンク:がん患者にも妊娠・出産の選択を! 日本初の「卵巣バンク」で何が変わるのか
(*注7) 卵母細胞:卵子のもとになる生殖細胞のこと。卵母細胞が発育すると、卵細胞を経て卵子となる
(*注8) 卵胞:1つの卵細胞とそれを取り巻く体細胞の集合体で、卵胞の中で卵子へと成熟していく
(*注9) 産仔(さんし):産まれたばかりの子
(*注10)参考リンク〈英語〉:www.sciencedirect.com/science/article/pii/S0015028206010867
がん治療後のQOL向上のために
卵巣組織を凍結保存するメリットとリスクは以下のような点が挙げられます。
〈メリット〉
・保存できる卵子の数が、卵子や受精卵の凍結保存に比べて圧倒的に多い。
・月経周期に左右されず、排卵誘発も不要であるため、短期間で保存が可能である。
=すぐに治療を行う必要がある患者に有用である。
〈リスク〉
・抗がん剤治療を受けた後の卵巣は、実年齢の約+10歳の機能になり、移植しても卵巣機能が回復しない可能性がある。(*注11)
・凍結保存後の卵巣を移植してもそこから妊娠に至るのは15%程度である。
・抗がん剤治療後すぐに凍結卵巣組織を移植するので感染症のリスクが高い。
・凍結卵巣組織の移植には、がん細胞の再導入の危険性がある。
以上のように、凍結卵巣組織の移植にもリスクが存在するため、卵巣組織の凍結保存に不安を抱く方もいるかもしれません。
しかし、凍結卵巣組織を体に戻すか戻さないかは、がんの治療が終わってから、自身の体と心と相談して決断することができるのです。
将来子どもを持つという選択肢ががん治療後に残っていることに、妊孕性温存治療の意味があるのではないでしょうか。
妊孕性消失への不安を少しでも解消し、がん治療に専念していただくこと、そしてがんの診断を受けた方のQOLが、がん治療後も充実することを願って私は日々、研究に取り組んでいます。
(*注11)卵巣は抗がん剤などに対して非常に敏感な臓器で、1回の抗がん剤治療によって約+1.5歳の機能になるという報告もある。卵巣機能の低下により、冷凍保存していた組織を移植しても卵巣の機能回復の可能性は低くなる。
(文・三澤知香)

